
Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Kodėl fotoreceptorių ląstelių išgyvenamumas nepasiekia 100%: išaiškinti pagrindiniai mechanizmai
Paskutinį kartą peržiūrėta: 09.08.2025
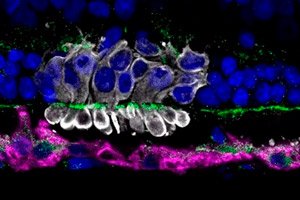
Pensilvanijos universiteto mokslininkai, vadovaujami Raghavi Sudharsan, atrado, kodėl apie 70 % persodintų fotosensorinių progenitorinių ląstelių (PRPC) iš indukuotų pluripotentinių kamieninių ląstelių žūsta per pirmąsias kelias dienas po transplantacijos į tinklainę. Jų darbas, paskelbtas žurnale „ Stem Cell Research & Therapy“, nurodo, kad pagrindinė ankstyvo ląstelių praradimo priežastis yra donorinių ląstelių metabolinis stresas.
Būtinos sąlygos
PRPC transplantacija laikoma perspektyviu progresuojančių degeneracinių tinklainės ligų (pigmentinio retinito, geltonosios dėmės degeneracijos) gydymo metodu. Tačiau mažas donorinių ląstelių išgyvenamumas riboja gydymo veiksmingumą. Iki šiol pagrindinis dėmesys buvo skiriamas imuninio atsako slopinimui, tačiau net ir esant didelei imunosupresijai, nuostoliai išliko katastrofiški.
Dizainas ir metodai
Modeliai:
Sveikiems šunims ir pigmentinio retinito modelio šunims buvo suleistos fluorescenciniu būdu žymėtų PRPC subretinaliai.
Išgyvenamumo įvertinimas:
Fluoresceino angiografija ir optinė koherentinė tomografija (OKT) užfiksavo persodintų ląstelių tūrį pirmąją, trečiąją ir septintąją dieną.
Vienos ląstelės transkriptomika (scRNR-seq):
PRPC buvo išskirti iš tinklainės vietų 3 dieną ir analizuota su metabolizmu ir apoptoze susijusių genų raiška.
Imunohistochemija:
Transplantacijos srityje buvo įvertinti oksidacinio streso žymenys (4-HNE), mitochondrijų būsena (Tom20) ir mikroglijos aktyvacija (Iba1).
Pagrindiniai rezultatai
- Masinis ląstelių netekimas: maždaug 70 % PRPC išnyko iki 7 dienos tiek sveikose, tiek degeneruojančiose tinklainėse, nepaisant imunosupresijos.
- Metabolinis stresas: scRNR sekoskaita atskleidė dramatišką oksidacinio fosforilinimo genų (CYCS, COX4I1) raiškos sumažėjimą ir apoptozės žymenų (BAX, CASP3) transkripcijos padidėjimą.
- Mitochondrijų disfunkcija: Imunohistochemija parodė transplantuotų PRPC fragmentaciją ir Tom20 žymėjimo praradimą, o padidėjęs 4-HNE kiekis rodė oksidacinį pažeidimą.
- Mikroglijos vaidmuo: Transplantacijos srityje Iba1⁺ mikroglijos ląstelių aktyvumas padidėjo reaguojant į PRPC žūtį, o tai galėjo sustiprinti vietinį uždegimą ir prisidėti prie tolesnių nuostolių.
Poveikis ląstelių terapijai
Šie atradimai keičia paradigmą: norint padidinti PRPC įsitvirtinimą, būtina ne tik slopinti imuninį atsaką, bet ir palaikyti donorinių ląstelių energijos apykaitą. Galimos intervencijos:
- Preliminarus PRPC „metabolinis paruošimas“ normaliomis kultūros sąlygomis, esant substreso apkrovai, siekiant padidinti jų mitochondrijų atsparumą.
- Mitochondrijų stabilizatorių (kofermento Q₁₀, karnitino) kokteiliai transplantacijos metu ir iškart po jos.
- Vietinės tinklainės mikroaplinkos moduliavimas: antioksidantų arba mitochondrijų apsauginių medžiagų pristatymas į transplantacijos sritį.
Praktinės išvados ir perspektyvos
- Metabolinis išankstinis parengimas: PRPC parengimas švelnioms metabolinio streso sąlygoms prieš transplantaciją, siekiant padidinti jų atsparumą.
- Pastolių pristatymas: biologiškai skaidžių matricų naudojimas, užtikrinantis laipsnišką donorinių ląstelių perėjimą iš sodrios kultūros terpės į tinklainės aplinką.
- Mitybos palaikymas: antioksidantų arba mitochondrijų kvėpavimo substratų tiekimas kartu su PRPC.
„Ilgą laiką kovojome tik su imuniniu barjeru, bet dabar aišku, kad neišsprendus metabolinio šoko problemos, transplantatai pasmerkti ankstyvai mirčiai“, – apibendrina Raghavi Sudharsan.
Šis darbas, kurį remia Nacionalinis akių institutas, atveria kelią perspektyvesnėms ląstelių terapijoms, skirtoms atkurti regėjimą pacientams, sergantiems degeneracinėmis tinklainės ligomis.
