
Visas „iLive“ turinys yra peržiūrėtas medicinoje arba tikrinamas, kad būtų užtikrintas kuo didesnis faktinis tikslumas.
Mes turime griežtas įsigijimo gaires ir susiejamos tik su geros reputacijos žiniasklaidos svetainėmis, akademinių tyrimų institucijomis ir, jei įmanoma, medicininiu požiūriu peržiūrimais tyrimais. Atkreipkite dėmesį, kad skliausteliuose ([1], [2] ir tt) esantys numeriai yra paspaudžiami nuorodos į šias studijas.
Jei manote, kad bet koks mūsų turinys yra netikslus, pasenęs arba kitaip abejotinas, pasirinkite jį ir paspauskite Ctrl + Enter.
Hepatito B patogenezė
Medicinos ekspertas
Paskutinį kartą peržiūrėta: 07.07.2025
Hepatito B patogenezėje galima nustatyti keletą pagrindinių patogenetinės grandinės grandžių:
- patogeno įvedimas - infekcija;
- fiksacija ant hepatocitų ir prasiskverbimas į ląstelę;
- viruso dauginimasis ir jo „išstūmimas“ į hepatocitų paviršių, taip pat į kraują;
- imunologinių reakcijų, skirtų patogenui pašalinti, aktyvavimas;
- imuninio komplekso pažeidimas organams ir sistemoms;
- imuniteto susidarymas, išsivadavimas iš patogeno, pasveikimas.
Kadangi hepatito B infekcija visada vyksta parenteraliai, galima laikyti, kad užsikrėtimo momentas praktiškai prilygsta viruso patekimui į kraują. Kai kurių tyrėjų bandymai atskirti enterinę ir regioninę hepatito B fazes yra menkai pagrįsti. Yra daugiau pagrindo manyti, kad virusas iš karto patenka į kepenis su kraujotaka.
Hepatito B viruso tropizmą kepenų audiniuose lemia specialaus receptoriaus buvimas HBsAg – 31 000 Da molekulinės masės polipeptido (P31), pasižyminčio albumino jungimosi aktyvumu. Panaši albumino zona yra ir žmonių bei šimpanzių kepenų hepatocitų membranose, kuri iš esmės lemia HBV tropizmą žmonių ir šimpanzių kepenims.
Kai virusas prasiskverbia į hepatocitą, išsiskiria virusinė DNR, kuri, patekusi į hepatocitų branduolį ir veikdama kaip matrica nukleorūgščių sintezei, sukelia nuoseklių biologinių reakcijų seriją, kurios rezultatas – viruso nukleokapsidės surinkimas. Nukleokapsidė per branduolio membraną migruoja į citoplazmą, kur vyksta galutinis Dane dalelių – pilno hepatito B viruso – surinkimas.
Tačiau reikėtų pažymėti, kad užsikrėtus hepatocitui, procesas gali vykti dviem būdais – replikaciniu ir integraciniu. Pirmuoju atveju išsivysto ūminio arba lėtinio hepatito vaizdas, o antruoju – viruso nešiojimas.
Priežastys, lemiančios dviejų tipų sąveiką tarp virusinės DNR ir hepatocitų, nebuvo tiksliai nustatytos. Labiausiai tikėtina, kad atsako tipas yra genetiškai nulemtas.
Replikacinės sąveikos rezultatas yra pagrindinių antigenų struktūrų (branduolyje) ir viso viruso (citoplazmoje) surinkimas, po kurio seka viso viruso arba jo antigenų pateikimas ant membranos arba hepatocitų membranos struktūroje.
Visuotinai pripažįstama, kad viruso replikacija nesukelia ląstelių pažeidimo hepatocitų lygmenyje, nes hepatito B virusas neturi citopatinio poveikio. Šios pozicijos negalima laikyti neginčijama, nes ji pagrįsta eksperimentiniais duomenimis, kurie, nors ir rodo hepatito B viruso citopatinio poveikio nebuvimą, buvo gauti tiriant audinių kultūras ir todėl negali būti visiškai ekstrapoliuoti virusiniam hepatitui B žmonėms. Bet kokiu atveju, hepatocitų pažeidimo nebuvimo replikacijos fazės metu klausimas reikalauja papildomų tyrimų.
Tačiau, nepriklausomai nuo viruso sąveikos su ląstele pobūdžio, kepenys būtinai dalyvauja imunopatologiniame procese. Šiuo atveju hepatocitų pažeidimas yra susijęs su tuo, kad dėl virusinių antigenų ekspresijos hepatocitų membranoje ir virusinių antigenų išleidimo į laisvą kraujotaką, prasideda nuoseklių ląstelinių ir humoralinių imuninių reakcijų grandinė, kurios galutinis tikslas – pašalinti virusą iš organizmo. Šis procesas atliekamas visiškai laikantis bendrųjų imuninio atsako į virusines infekcijas modelių. Patogenui pašalinti įtraukiamos ląstelinės citotoksinės reakcijos, kurias tarpininkauja įvairios efektorinių ląstelių klasės: K ląstelės, T ląstelės, natūralūs žudikai, makrofagai. Šių reakcijų metu sunaikinami užkrėsti hepatocitai, o tai lydi virusinių antigenų (HBcAg, HBeAg, HBsAg) išsiskyrimą, kurie suaktyvina antikūnų genezės sistemą, dėl ko kraujyje kaupiasi specifiniai antikūnai, pirmiausia prieš šerdį – anti-HBc ir e-antigenus – anti-HBE. Todėl kepenų ląstelės išsiskiria iš viruso jo mirties metu dėl ląstelių citolizės reakcijų.
Tuo pačiu metu kraujyje kaupiasi specifiniai antikūnai, jungiasi su viruso antigenais, sudarydami imuninius kompleksus, kuriuos fagocituoja makrofagai ir išskiria inkstai. Tokiu atveju gali pasireikšti įvairūs imuninių kompleksų pažeidimai, tokie kaip glomerulonefritas, arteritas, artralgija, odos bėrimai ir kt. Dalyvaujant specifiniams antikūnams, organizmas išvalomas nuo patogeno ir įvyksta visiškas pasveikimas.
Remiantis apibrėžta hepatito B patogenezės koncepcija, visa klinikinių ligos eigos variantų įvairovė paprastai paaiškinama viruso sąveikos ir imunokompetentinių ląstelių bendradarbiavimo ypatumais, kitaip tariant, imuninio atsako į virusinių antigenų buvimą stiprumu. Pagal šiuolaikines koncepcijas, imuninio atsako stiprumas yra genetiškai nulemtas ir susijęs su pirmos klasės HLA lokuso histosuderinamumo antigenais.
Visuotinai pripažįstama, kad esant pakankamam imuniniam atsakui į viruso antigenus, ūminis hepatitas kliniškai išsivysto cikliškai ir visiškai pasveiksta. Sumažėjus imuniniam atsakui į viruso antigenus, imuninio tarpininkavimo citolizė yra nereikšminga, todėl nėra veiksmingo užkrėstų kepenų ląstelių eliminavimo, o tai sukelia lengvas klinikines apraiškas, ilgalaikį viruso išlikimą ir, galbūt, lėtinio hepatito vystymąsi. Tuo pačiu metu, priešingai, esant genetiškai nulemtam stipriam imuniniam atsakui ir masinei infekcijai (hemotransfuzijai), atsiranda dideli kepenų ląstelių pažeidimo plotai, kurie kliniškai atitinka sunkias ir piktybines ligos formas.
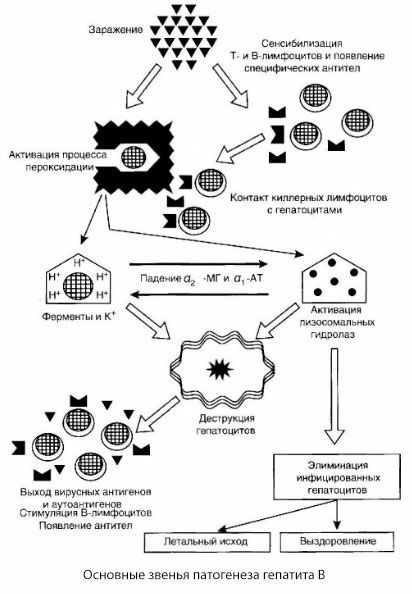
Pateikta hepatito B patogenezės schema pasižymi savo nuoseklumu, tačiau joje yra nemažai prieštaringų ir mažai ištirtų punktų.
Jei laikysimės hepatito B kaip imunopatologinės ligos koncepcijos, galime tikėtis padidėjusio ląstelių citotoksiškumo reakcijų, didėjant ligos sunkumui. Tačiau sunkiomis formomis ląstelinio imuniteto ryšio rodikliai smarkiai sumažėja, įskaitant daugkartinį sumažėjimą, palyginti su sveikų vaikų rodikliais, ir K ląstelių citotoksiškumo indeksas. Piktybinės formos atveju, masinės kepenų nekrozės ir ypač kepenų komos vystymosi laikotarpiu, pastebimas visiškas limfocitų nesugebėjimas blastinės transformacijos veikiant fitohematliutininui, stafilokokiniam endotoksinui ir HBsAg. Be to, leukocitai neturi gebėjimo migruoti pagal leukocitų migracijos slopinimo reakciją (LMIC), o tyrimų, atliktų naudojant fluorescencinį tetraciklino zondą, rezultatai rodo staigų limfocitų membranų pralaidumo padidėjimą.
Taigi, jei sveikų žmonių limfocitų fluorescencijos rodikliai yra 9,9±2%, o tipiško gerybinės eigos hepatito B atveju jie padidėja iki 22,3±2,7%, tai piktybinių formų atveju fluorescencinių limfocitų skaičius siekia vidutiniškai 63,5±5,8%. Kadangi literatūroje ląstelių membranų pralaidumo padidėjimas vienareikšmiškai vertinamas kaip patikimas jų funkcinio prastumo rodiklis, galima daryti išvadą, kad sergant hepatitu B, ypač piktybine forma, limfocitai yra smarkiai pažeisti. Tai įrodo ir K ląstelių citotoksiškumo rodikliai. Esant sunkiai formai, 1–2 ligos savaitę citotoksiškumas yra 15,5±8,8%, o piktybinės formos atveju – 1 savaitę – 6,0±2,6, 2 savaitę – 22,0±6,3%, norma – 44,8±2,6%.
Pateikti duomenys aiškiai rodo ryškius imuniteto ląstelinio ryšio sutrikimus pacientams, sergantiems sunkiomis hepatito B formomis. Taip pat akivaizdu, kad šie pokyčiai atsiranda antriniu būdu dėl imunokompetenčių ląstelių pažeidimo toksiškais metabolitais ir, galbūt, cirkuliuojančiais imuniniais kompleksais.
Tyrimai parodė, kad pacientams, sergantiems sunkiomis hepatito B formomis, ypač išsivysčius masyviai kepenų nekrozei, HBsAg ir HBeAg titras kraujo serume mažėja, o tuo pačiu metu pradedami aptikti dideli antikūnai prieš paviršiaus antigeną, o tai visiškai nebūdinga gerybinėms ligos formoms, kai anti-HBV pasireiškia tik 3–5 ligos mėnesiais.
Greitas hepatito B viruso antigenų išnykimas kartu su dideliais antivirusinių antikūnų titrais rodo intensyvų imuninių kompleksų susidarymą ir galimą jų dalyvavimą masinės kepenų nekrozės vystymosi patogenezėje.
Taigi, faktinė medžiaga neleidžia vienareikšmiškai interpretuoti hepatito B vien imunopatologinės agresijos požiūriu. Ir esmė ne tik ta, kad nerandama jokio ryšio tarp kepenų morfologinių pokyčių gylio ir paplitimo, viena vertus, ir ląstelinio imuniteto veiksnių sunkumo, kita vertus. Teoriškai šią aplinkybę galima paaiškinti vėlyvaisiais ląstelinio imuniteto rodiklių tyrimo etapais, kai imunokompetentės ląstelės dėl didėjančio kepenų funkcinio nepakankamumo patyrė stiprų toksinį poveikį. Žinoma, galima daryti prielaidą, kad hepatocitų imuninė citolizė vyksta ankstyviausiose infekcinio proceso stadijose, galbūt net prieš pasireiškiant klinikiniams sunkios kepenų pažeidimo simptomams. Tačiau tokia prielaida mažai tikėtina, nes panašūs ląstelinio imuniteto rodikliai buvo nustatyti pacientams, sergantiems ūmiausia (žaibiška) ligos eiga, be to, atliekant kepenų audinio morfologinį tyrimą, masyvi limfocitinė infiltracija nebuvo nustatyta, o tuo pačiu metu buvo aptikti ištisiniai nekrozinio epitelio laukai be rezorbcijos ir limfocitinės agresijos reiškinių.
Labai sunku paaiškinti ūminio hepatito morfologinį vaizdą vien tik imuninės ląstelės citolizės požiūriu, todėl ankstyvuosiuose tyrimuose nebuvo atmestas hepatito B viruso citotoksinis poveikis.
Šiuo metu šią prielaidą iš dalies patvirtina hepatito B viruso atradimas. Tyrimai parodė, kad hepatito D žymenų nustatymo dažnis tiesiogiai priklauso nuo ligos sunkumo: lengvos formos atveju jie aptinkami 14%, vidutinio sunkumo – 18%, sunkios – 30%, o piktybinės – 52% pacientų. Atsižvelgiant į tai, kad hepatito D virusas turi nekrogeninį citopazinį poveikį, galima laikyti nustatyta, kad koinfekcija hepatito B ir D virusais yra labai svarbi žaibiškų hepatito B formų vystymuisi.
Hepatito B patogenezę galima apibūdinti taip. Hepatito B virusui patekus į hepatocitus, imunologinę ataką prieš užkrėstus hepatocitus sukelia T-žudikai, kurie išskiria limfotoksinus kepenų ląstelių kryptimi.
Tikslūs hepatocitų pažeidimo mechanizmai sergant hepatitu B dar nėra nustatyti. Pagrindinį vaidmenį atlieka aktyvuoti lipidų peroksidacijos ir lizosominių hidrolazių procesai. Paleidiklis gali būti limfotoksinai, išsiskiriantys iš efektorinių ląstelių, kai jos kontaktuoja su hepatocitais, tačiau gali būti, kad pats virusas gali būti peroksidacijos procesų iniciatorius. Vėliau patologinis procesas greičiausiai vystosi tokia seka.
- Agresijos faktoriaus (limfotoksinų ar viruso) sąveika su biologinėmis makromolekulėmis (galbūt su endoplazminio tinklo membranų komponentais, galinčiais dalyvauti detoksikacijos procesuose, pagal analogiją su kitais žalingais veiksniais, kaip buvo parodyta anglies tetrachlorido atveju).
- Laisvųjų radikalų susidarymas, lipidų peroksidacijos procesų aktyvavimas ir visų hepatocelulinių membranų pralaidumo padidėjimas (citolizės sindromas).
- Biologiškai aktyvių medžiagų judėjimas išilgai koncentracijos gradiento – įvairių tarpląstelinių lokalizacijų fermentų, energijos donorų, kalio ir kt. praradimas. Natrio ir kalcio kaupimasis ląstelėse, pH poslinkis link tarpląstelinės acidozės.
- Lizosominių hidrolazių (RNRazės, DNRazės, katepsinų ir kt.) aktyvavimas ir išsiskyrimas, skaidant kepenų ląsteles ir išskiriant autoantigenus.
- T ir B imuninių sistemų stimuliavimas, sukeliant specifinį T limfocitų jautrinimą kepenų lipoproteinams, taip pat antihepatinių humoralinių autoantikūnų susidarymą.
Siūlomoje hepatito B patogenezės schemoje sukeliantis veiksnys yra virusiniai antigenai, kurių intensyvi gamyba stebima ankstyviausiose ligos stadijose ir per visą ūminį laikotarpį, išskyrus piktybines formas, kai virusinių antigenų gamyba praktiškai nutrūksta išsivysčius masinei kepenų nekrozei, kuri lemia spartų viruso replikacijos sumažėjimą.
Taip pat akivaizdu, kad virusiniai antigenai aktyvuoja imunitetą T ir B sistemomis. Šio proceso metu vyksta būdingas T limfocitų pogrupių persiskirstymas, kuriuo siekiama organizuoti tinkamą imuninį atsaką, pašalinti užkrėstus hepatocitus, neutralizuoti virusinius antigenus, sanogenezę ir atsigavimą.
Kai imunokompetentės ląstelės sąveikauja su virusiniais antigenais hepatocitų membranose arba viruso dauginimosi hepatocitų viduje metu, susidaro sąlygos lipidų peroksidacijos procesų aktyvacijai, kuri, kaip žinoma, kontroliuoja visų ląstelių ir subląstelinių membranų pralaidumą.
Iš šios pozicijos tampa suprantamas citolizės sindromo atsiradimas, padidėjęs ląstelių membranų pralaidumas, kuris yra toks natūralus ir labai būdingas virusiniam hepatitui.
Galutinis citolizės sindromo rezultatas gali būti visiškas oksidacinio fosforilinimo atsijungimas, ląstelinės medžiagos nutekėjimas ir kepenų parenchimos žūtis.
Tačiau didžiąja dauguma atvejų šie procesai nepasiekia tokios mirtinos eigos. Tik esant piktybinėms ligos formoms, patologinis procesas vyksta lavinai ir negrįžtamai, nes atsiranda masinė infekcija, ryškus imuninis procesas, per didelis peroksidacijos procesų ir lizosominių hidrodazių aktyvavimas, autoimuninės agresijos reiškiniai.
Tie patys mechanizmai stebimi ir palankioje hepatito B eigoje, vienintelė ypatybė – jie visi realizuojami kokybiškai skirtingu lygiu. Skirtingai nuo masinės kepenų nekrozės atvejų, palankios ligos eigos metu užkrėstų hepatocitų skaičius, taigi ir imunopatologinės citolizės zona, yra mažesnis, lipidų peroksidacijos procesai nėra taip ženkliai sustiprėję, rūgščių hidrolazių aktyvacija sukelia tik ribotą autolizę su nereikšmingu autoantigenų išsiskyrimu, todėl be masinės autoagresijos, t. y. visi patogenezės etapai palankios eigos metu vyksta pagal išsaugotą kepenų parenchimos struktūrinę organizaciją ir yra suvaržyti gynybinių sistemų (antioksidantų, inhibitorių ir kt.), todėl neturi tokio destruktyvaus poveikio.
Virusinio hepatito intoksikacijos simptomų priežastys nėra iki galo ištirtos. Pasiūlymas atskirti vadinamąją pirminę, arba virusinę, intoksikaciją nuo antrinės (maininės, arba metabolinės), gali būti laikomas teigiamu, nors tai neatskleidžia intymaus bendrojo toksinio sindromo atsiradimo mechanizmo. Pirma, hepatito virusai neturi toksinių savybių, antra, daugelio metabolitų koncentracija ne visada koreliuoja su ligos sunkumu ir toksikozės simptomų išraiškos laipsniu. Taip pat žinoma, kad virusinių antigenų koncentracija nėra griežtai susijusi su intoksikacijos sunkumu. Priešingai, didėjant ligos sunkumui, taigi ir toksikozės laipsniui, HBsAg koncentracija mažėja ir mažiausia esant piktybinėms formoms, kai prasideda gili kepenų koma. Tuo pačiu metu specifinių antivirusinių antikūnų nustatymo dažnis ir titrai tiesiogiai priklauso nuo ligos sunkumo.
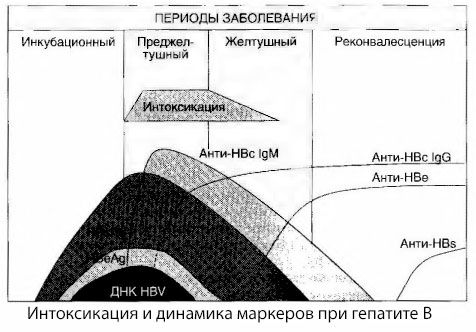
Apsinuodijimas pasireiškia ne virusinių antigenų registravimo metu, o antivirusinių IgM klasės antikūnų prieš karvės antigeną ir E sistemos antigeną cirkuliacijos kraujyje laikotarpiu. Be to, esant sunkioms ir ypač piktybinėms formoms, didelė dalis pacientų netgi turi anti-HBs kraujyje, kuris paprastai niekada nepastebimas esant lengvam ir vidutinio sunkumo ligos pavidalu.
Pateikti duomenys leidžia daryti išvadą, kad virusinio hepatito, o ypač hepatito B, toksikozės sindromas neatsiranda dėl virusinių antigenų atsiradimo kraujyje, bet yra virusinių antigenų sąveikos su IgM klasės antivirusiniais antikūnais pasekmė. Tokios sąveikos rezultatas, kaip žinoma, yra imuninių kompleksų ir, galbūt, aktyvių toksinių medžiagų susidarymas.
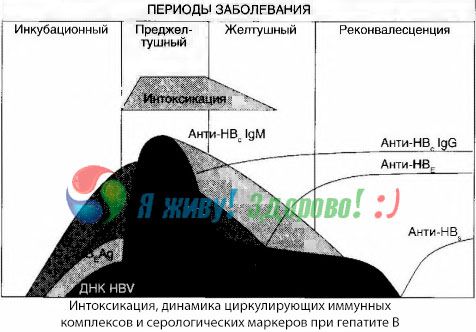
Apsinuodijimo simptomai atsiranda imuninių kompleksų atsiradimo laisvoje kraujotakoje metu, tačiau vėliau tokia koreliacija nepastebėta.
Dalinį to paaiškinimą galima rasti tiriant imuninių kompleksų sudėtį. Pacientams, sergantiems sunkiomis formomis, kraujyje daugiausia cirkuliuoja vidutinio dydžio kompleksai, kurių sudėtyje, toksinio sindromo piko metu, vyrauja šios klasės antikūnai, o klinikinių apraiškų silpnėjimo ir sveikimo laikotarpiu kompleksai tampa didesni, o jų sudėtyje pradeda dominuoti IgG klasės antikūnai.
Pateikti duomenys susiję su toksinio sindromo išsivystymo mechanizmais pradiniu ligos laikotarpiu, tačiau toksikozės atveju, pasireiškiant klinikinių apraiškų įkarštyje, jie turi tik dalinę reikšmę, ypač kepenų komos vystymuisi.
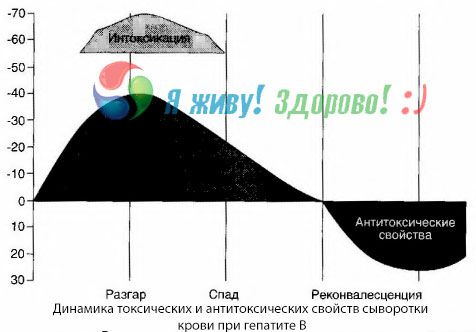
Kraujo pasėlių metodas parodė, kad sergant hepatitu B kraujyje nuolat kaupiasi toksinai, išsiskiriantys iš pažeisto, irstančio kepenų audinio. Šių toksinų koncentracija yra proporcinga ligos sunkumui, jie yra baltyminio pobūdžio.
Atsigavimo laikotarpiu kraujyje atsiranda antikūnų prieš šį toksiną; tačiau kepenų komos atveju toksino koncentracija kraujyje smarkiai padidėja, o antikūnų kraujyje neaptinkama.
Hepatito B patomorfologija
Remiantis morfologinių pokyčių pobūdžiu, išskiriamos trys ūminio hepatito B formos:
- ciklinė forma,
- masinė kepenų nekrozė;
- cholestazinis pericholangiolitinis hepatitas.
Ciklinės hepatito B formos atveju distrofiniai, uždegiminiai ir proliferaciniai pokyčiai labiau išreikšti skiltelių centre, o sergant hepatitu A jie lokalizuojasi skiltelės periferijoje, plinta į centrą. Šie skirtumai paaiškinami skirtingais viruso prasiskverbimo į kepenų parenchimą keliais. Hepatito A virusas patenka į kepenis per vartų veną ir plinta į skiltelių centrą, hepatito B virusas prasiskverbia per kepenų arteriją ir kapiliarų šakas, kurios tolygiai aprūpina kraują visomis skiltelėmis, iki pat jų centro.
Kepenų parenchimos pažeidimo laipsnis daugeliu atvejų atitinka klinikinių ligos apraiškų sunkumą. Lengvomis formomis dažniausiai stebima židininė hepatocitų nekrozė, o vidutinio sunkumo ir sunkiomis formomis – zoninė nekrozė (sunkiomis ligos formomis linkusi susilieti ir formuoti tilto formos nekrozę).
Didžiausi parenchimos morfologiniai pokyčiai stebimi klinikinių apraiškų įkarštyje, kuris paprastai sutampa su pirmuoju ligos dešimtmečiu. Antruoju ir ypač trečiuoju dešimtmečiais suintensyvėja regeneracijos procesai. Šiuo laikotarpiu nekrobiotiniai pokyčiai beveik visiškai išnyksta ir pradeda dominuoti ląstelių infiltracijos procesai, po kurių lėtai atsistato kepenų ląstelių plokštelių struktūra. Tačiau visiškas kepenų parenchimos struktūros ir funkcijos atsistatymas įvyksta tik po 3–6 mėnesių nuo ligos pradžios ir ne visiems pacientams.
Generalizuotą hepatito B infekcijos pobūdį patvirtina HBsAg nustatymas ne tik hepatocituose, bet ir inkstuose, plaučiuose, blužnyje, kasoje, kaulų čiulpų ląstelėse ir kt.
Cholestatinis (pericholangiolitinis) hepatitas yra ypatinga ligos forma, kai didžiausi morfologiniai pokyčiai pastebimi intrahepatinių tulžies latakų dalyje, pasireiškiant cholangiolitu ir pericholangiolitu. Sergant cholestazine forma, cholestazė pasireiškia išsiplėtus tulžies kapiliarams, juose sustingus tulžiai, proliferavus cholangiolei ir aplink ją susidarius ląstelių infiltratams. Sergant šia hepatito forma, kepenų ląstelės pažeidžiamos nereikšmingai. Kliniškai ligai būdinga užsitęsusi eiga su užsitęsusia gelta. Įrodyta, kad tokios savitos ligos eigos priežastis yra vyraujantis viruso poveikis cholangiolės sienelėms, o hepatocitams poveikis nereikšmingas.

